卤素的物理性质【卤素的物理性质,卤族元素物理性质的相似性和递变性】

单质的物理递变性:从氟单质到碘单质,颜色由浅变深;状态由气态、液态到固态;熔沸点逐渐升高;密度逐渐增大;溶解性逐渐减小 。
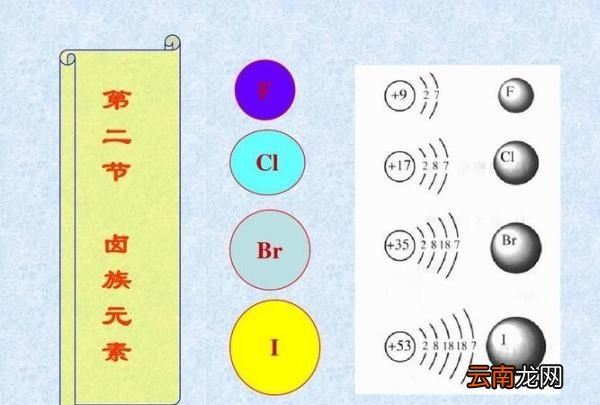
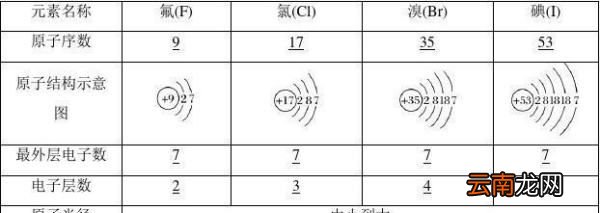
最外层电子数相同,均为7个电子 , 由于电子层数不同,原子半径不同 , 从氟到碘原子半径依次增大 , 因此原子核对最外层的电子的吸引能力依次减弱,从外界获得电子的能力依次减弱,单质的氧化性减弱 。
卤族元素物理性质的相似性和递变性卤族元素指周期系ⅦA族元素 。包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At),简称卤素 。它们在自然界都以典型的盐类存在 ,是成盐元素 。卤族元素的单质都是双原子分子,它们的物理性质的改变都是很有规律的,随着分子量的增大,卤素分子间的色散力逐渐增强,颜色变深,它们的熔点、沸点、密度、原子体积也依次递增 。卤素都有氧化性 , 氟单质的氧化性最强 。
卤族单质的物理递变性:从F2到I2,颜色由浅变深;状态由气态、液态到固态;熔沸点逐渐升高;密度逐渐增大;溶解性逐渐减小 。
原子结构: 相同点①最外层电子数相等,均为7
②都容易得电子,都具有氧化性,都显-1价
递变性①电子层数逐渐增多
②得电子能力减弱
③非金属性、氧化性减弱
1. 相似性
(1)物理性质:卤素单质的密度较?。?硬度较小,熔点较低 。
(2)卤素都是活泼的非金属单质,均能与H2、活泼金属、水等反应 。如与H2反应:X2+H2===2HX , 与水反应:X2+H2O===HX+HXO(X为Cl、Br、I),2F2+2H2O===4HF+O2.
2. 递变性
(1)物理性质:按照F、Cl、Br、I的顺序,卤素单质的颜色依次加深,熔、沸点依次升高,密度依次增大 。
(2)随着元素原子序数的递增,卤素单质的氧化性逐渐减弱,阴离子的还原性逐渐增强 。即氧化性:F2>Cl2>Br2>I2,还原性:F-
化学性质:强氧化性:卤素的化学性质由于最外层均为7个电子,极易得一个电子,因此卤素都是强氧化剂 , 在自然界均只以化合态存在 。并且,随着电子层数递增,原子半径渐增大,核对外层电子的引力渐减弱,得电子能力渐减弱,其氧化性逐渐减弱 。因此氟是这些单质中氧化性最强的 。
卤素基础知识总结卤素是第ⅦA族非金属元素,包括了氟、氯、溴、碘和砹五种元素,合称卤素 。那么你对卤素了解多少呢?以下是由我整理关于卤素知识的内容 , 希望大家喜欢!
卤素的物理、化学特性
通常来说,液体卤素分子的沸点均要高于它们所对应的烃链(alcane) 。这主要是由于卤素分子比烃链更加电极化,而分子的电极化增加了分子之间的连接力(正电极与负电极的相互吸引),这使我们需要对液体提供更多的能量才能使其蒸发 。
卤素的物理特性和化学特性明显区分与于它对应的烃链的主要原因 , 在于卤素原子(如F,Cl,Br,I)与碳原子的连接,即C-X的连接,明显不同于烃链C-H连接 。
* 由于卤素原子通常具有较大的负电性,所以C-X连接比C-H连接更加电极化,但仍然是共价键 。
* 由于卤素原子相较于碳原子,通常体积和质量较大,所以C-X连接的偶极子矩(Dipole Moment)和键能量(Bonding Energy)远大于C-H , 这些导致了C-X的连接力(Bonding strength)远小于C-H连接 。
* 卤素原子脆弱的p轨道(Orbital)与碳原子稳定的sp3轨道相连接,这也大大降低了C-X连接的稳定性 。
位于元素周期表右方的卤族元素是典型的非金属 。卤素的电子构型均为ns2np5,它们获取一个电子以达到稳定结构的趋势极强烈 。所以化学性质很活泼,自然状态下不能以单质存在,一般化合价为-1价,即卤离子(X-)的形式 。
卤素单质都有氧化性,氧化性从氟到碘依次降低 。碘单质氧化性比较弱,三价铁离子可以把碘离子氧化为碘 。
卤素单质在碱中容易歧化 , 方程式为:
3X2 + 6OH- = 5X- + XO3- + 3H2O
但在酸性条件下,其逆反应很容易进行:
5X- + XO3- + 6H+ = 3X2 + 3H2O
这一反应是制取溴和碘单质流程中的最后一步 。
卤素的氢化物叫卤化氢,为共价化合物;而其溶液叫氢卤酸,因为它们在水中都以离子形式存在 , 且都是酸 。氢氟酸一般看成是弱酸,pKa=3.20 。氢氯酸(即盐酸)、氢溴酸、氢碘酸都是化学中典型的强酸,它们的pKa均为负数,酸性从HCl到HI依次增强 。
卤素可以显示多种价态 , 正价态一般都体现在它们的含氧酸根中:
+1: HXO(次卤酸)
+3: HXO2(亚卤酸)
+5: HXO3(卤酸)
+7: HXO4(高卤酸)
卤素的含氧酸均有氧化性 , 同一种元素中 , 次卤酸的氧化性最强 。
卤素的氧化物都是酸酐 。像二氧化氯(ClO2)这样的偶氧化态氧化物是混酐 。
只由两种不同的卤素形成的化合物叫做互卤化物,其中显电正性的一种元素呈现正氧化态 , 氧化态为奇数 。这是由于卤素的价电子数是奇数,周围以奇数个 其它 卤原子与之成键比较稳定(如IF7) 。互卤化物都能水解 。
卤素的有机化学反应
在有机化学中 , 卤族元素经常作为决定有机化合物化学性质的官能团存在 。
氯的存在范围最广,按照氟、溴、碘的顺序减少 , 砹是人工合成的元素 。卤素单质都是双原子分子,都有很强的挥发性,熔点和沸点随原子序数的增大而增加 。常温下 , 氟、氯是气体、溴是液体,碘是固体 。
卤素最常见的有机化学反应为亲核性取代反应(nucleophilic substitution) 。
通常的化学式如:
Nu:- + R-X ----> R-Nu + X-
"Nu:-"在这里代表亲核负离子,离子的亲核性越强 , 则产率和化学反应的速度越可观 。
"X"在这里代表卤素原子,如F,Cl,Br,I,若X-所对应的酸(即HX)为强酸,那么产率和反应的速度将非常可观,如果若X-所对应的酸为弱酸,则产率和反应的速度均会下降 。
卤素单质的稳定性论化学性质是碘稳定 , 因为Cl的非金属性强,Cl2的性质活泼 。
卤素单质包括氟,氯 , 溴,碘 。它们都是双原子分子,固态时为分子晶体 , 因此熔点、沸点都比较低 。
?
常温常压下,氟是浅黄色气体,氯是黄绿色气体,溴是红棕色液体,碘是紫黑色带有金属光泽的固体 。在温度为293 K ,压力超过668.7 kPa时 ,气态氯可转变为液态氯 。固态碘因具有高的蒸气压 , 加热时产生升华现象 。
推荐阅读
- 可乐鸡翅的家常制作方法,可乐鸡翅的家常做法生抽放多少量
- 卤蛋的卤水怎么做,卤蛋怎么做的全过程视频
- 可怜日暮嫣香落的下一句是什么
- 卤鸡翅的详细做法,麻辣卤鸡翅的制作方法和配料
- 泸州一日游景点推荐,泸州有什么好玩的地方或景点
- 可以查询成绩的软件,查高考成绩的软件有哪些
- 卤代烷如何变成醇,烃 卤代烃 醇之间的转化
- 卤化反应的机理,有机卤化物反应活性顺序
- 四川红桥猪儿粑的家常做法
- 白首成语,白字开头的成语














